がんのエピジェネティック治療
【エピジェネティクスとは?】
ヒトの体は膨大な数の細胞によって形作られています。これらの細胞が持つゲノムは基本的には同じですが、遺伝子の発現パターンは細胞の機能に応じて異なっています。このような違いは、細胞が必要な遺伝子と不要な遺伝子にそれぞれ目印をつけているために生じます。この目印がエピジェネティクスです。例えば、プロモーター領域のDNAメチル化は不要な遺伝子の目印として機能します。1983年にヒトのがん細胞でDNAメチル化に異常がある事が明らかにされたことを皮切りに、現在までに様々ながんの発生や進展にエピジェネティクスが関与することがわかっています。
【治療標的としてのエピジェネティクス】
骨髄異形成症候群(MDS)は、重度の造血障害と骨髄の過形成を特徴とする造血器腫瘍です。MDS患者の骨髄の細胞ではエピジェネティクスを制御する遺伝子が高い頻度で変異していることが知られています。2004年に、アメリカでアザシチジンという薬のMDSへの適応が承認されました。アザシチジンはDNAメチル化を阻害する作用があることから、エピジェネティクスの異常を修正して効果を発揮していると考えられています。また、2006年にヒストンアセチル化阻害剤SAHAの皮膚T細胞性リンパ腫への適応が承認され、エピジェネティクスががん治療における有望な治療標的であることが広く認識されました。日本ではアザシチジン、SAHAはともに2011年に承認されています。エピジェネティクスを標的にする薬の開発は、現在も盛んに行われています。
【DNAメチル化の簡便な計測法の開発と応用】
アザシチジン治療をうけたMDS患者のおよそ半数で造血の回復がみとめられます。しかし、残りの患者では効果がみられません。また、効果のあった患者でも、アザシチジンが効かなくなる例もあります。アザシチジンが効かなくなった患者の予後は非常に悪いことが知られており、耐性化の早期予測は大きな課題でした。私たちの研究部門では耐性化の早期予測を目的に、患者末梢血細胞のDNAメチル化に着目して東京医科大学血液内科学分野と共同研究を展開してきました。私たちがこの研究に着手した当時、DNAメチル化を高い精度で計測するには煩雑な実験操作が必要で、日常的に用いることは困難でした。そこで、簡便で精確なDNAメチル化計測法の開発に取り組み、Single molecular methylation assay法(SMMA法)を発表しました(参考文献1)。この方法を用いるとDNAのメチル化を1分子レベルで解析することが可能です。現在、このSMMA法を用いて、患者末梢血細胞のDNAメチル化がアザシチジンへの感受性や耐性の予測の指標となるのか検討を進めています。
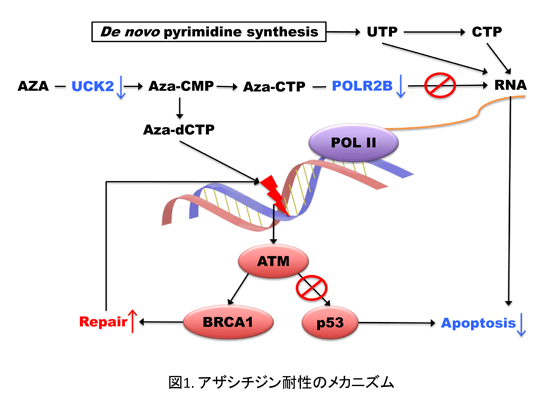
【アザシチジン耐性のメカニズム解明と、耐性克服方法の開発】
アザシチジンはなぜ効かなくなるのか?そのメカニズムがわかれば、アザシチジンが効かなくなった患者に良く効く治療法の開発や、耐性の予防方法の開発につながるかもしれません。そこで私たちはヒト白血病細胞からアザシチジン耐性細胞を樹立し、耐性メカニズムの解明に取り組みました。アザシチジンはRNAやDNAの材料の一つシチジンと類似した構造をしているので、細胞内ではシチジンと同様に代謝され、RNAやDNAに取り込まれます。私たちの研究室で樹立した2株のアザシチジン耐性細胞は、通常のシチジン代謝を抑制し、代わりに他の物質からシチジンを合成していることが明らかになりました(図1 & 参考文献2)。そこで、シチジン合成を阻害することが知られている薬剤をアザシチジン耐性細胞に加えたところ、アザシチジンへの感受性が回復することを突き止めました。この薬剤はMDS以外の疾患の治療で臨床使用されており、アザシチジン耐性を克服する新たな方法となることが期待できます(特許出願中: 特願2015-183778)。さらにアザシチジン耐性細胞ではDNAメチル化が極端に低いレベルになっており、DNAの傷を修復するシステムが常時活性化されていました(2)。DNA修復システムがアザシチジン耐性に果たす役割についても、検討を進めています。またDNAメチル化以外のエピジェネティクスの役割についても研究を開始しています。
【エピジェネティクス研究のこれから】
エピジェネティクスを標的とする薬剤は、いまや抗がん剤開発の主流となっています。しかし、これらの薬の抗がん作用には、未解明の部分が残されています。これらの薬を通してがんを考えることで、がんの秘密に迫ることができるかもしれません。一方で近年、DNAやヒストンの修飾だけではなく、転写後修飾やnon-coding RNAがエピジェネティクス制御に重要な役割を果たすことが明らかにされ、エピジェネティクス研究の裾野は広がり続けています。私たちの研究部門でも、non-coding RNAによるテロメア制御や、マイクロRNAによるがん微小環境の制御に関する研究を展開しています。がんの新たな側面を明らかにし、がん治療に貢献することを目的に、バイオロジーから臨床研究まで、様々なアプローチで研究を展開して行きたいと考えています。
| 参考文献 | |
| 1. | Umezu T, Ohyashiki K, Ohyashiki JH. Detection method for quantifying global DNA methylation by fluorescence correlation spectroscopy. Anal Biochem. 2011 Aug 15;415(2):145-50 [pubmed] |
| 2. | manishi S, Umezu T, Ohtsuki K, Kobayashi C, Ohyashiki K, Ohyashiki JH. Constitutive activation of the ATM/BRCA1 pathway prevents DNA damage-induced apoptosis in 5-azacytidine-resistant cell lines. Biochem Pharmacol. 2014 Jun 1;89(3):361-9. [pubmed] |
| *本研究は、文部科学省・私立大学戦略的研究基盤形成支援事業(課題番号 S1311016)「生体分子情報による次世代型がん個別最適化治療法の開発」の助成を受けたものです。 |