診療案内はこちら ⇒ 東京医科大学病院 脳神経外科 ホームページ
脳腫瘍の診断ではその起源となった細胞によって多少異なるものの、一般にはWHO(World Health Organization:世界保健機構)の病理分類によってグレード1から4に分けれらます。このグレードを腫瘍の悪性度と言い、腫瘍によってその意味あいは異なりますが、1が最良性型、4が最悪性型と考えることが一般的です。
良性か悪性かを含めた腫瘍の性質は、MRIや脳血管撮影、さらにはSPECTやPETといった術前画像にて、その発生部位、形、周囲脳への影響、造影後の変化、血管新生度、核種の集積度などをみれば、8割程度で予測可能です。又、腫瘍の性質をみれば、生じ得る症状、痙攣発症の危険性、今後の進行などを十分予想することもできます。
良性腫瘍が疑われた場合は、既に症状を呈している場合を除き、今後の進行を予測することが治療の要否を決定する上で重要になります。1~2か月毎にMRIを撮影し、増大してくる場合や、症状を出し得ると判断した場合には積極的な治療適応となりましょう。
悪性脳腫瘍が疑われた場合は、急速に増大する可能性が高いため、現在症状が無くても積極的に治療を考慮する場合が多くなります。
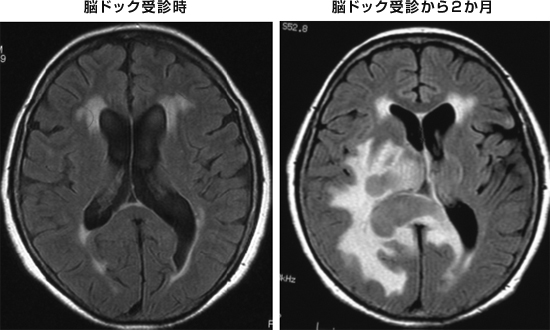 |
図1:急速に増大したリンパ腫症例 |
しかし、最終的に良性・悪性を決定するのは、病理組織診断です。その観点から脳腫瘍の診断には全例手術を行い、組織診断を行うことの必然性を御理解いただけるものと思います。
腫瘍を構成する細胞の密度、細胞の異型性、核分裂像の程度、新生血管増殖あるいは壊死の四項目を持ってグレードが決定されます。従来は一つ一つの因子が独立した因子であり、一つあればグレード2、2つで3などとされていましたが、2007年に改定されたWHO分類からは、新生血管増生・壊死があれば他の因子が無くてもグレード4とすると記されました。グレードを判定する補助因子として細胞増殖能(MIB-1 index)というものが用いられます。MIB-1は増殖能を有する腫瘍細胞核だけに発現するので、100個の腫瘍細胞の中で5個にMIB-1が発現していれば5%の陽性率となります。一般にグレード1は0-2%、グレード2は2-5%、グレード3は5-20%、グレード4は20%以上を示すことが多い様です。
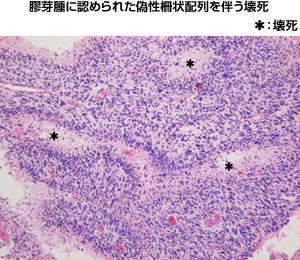 |
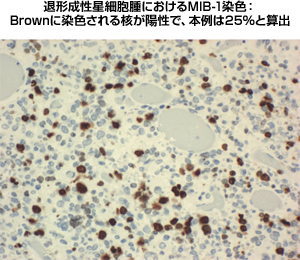 |
|
図2:壊死像を呈するグレード4のグリオーマ |
図3:グレード3のMIB1染色像 |
悪性脳腫瘍とは腫瘍の悪性度がグレード3、4を示す腫瘍のことをいいます。脳には様々な細胞がありますが、脳実質内で最も数が多いのがグリア細胞で、脳の神経細胞に栄養を与え、神経細胞の興奮を調整している働きがあります。このグリア細胞から発生した腫瘍をグリオーマ(神経膠腫:しんけいこうしゅ)と呼びます。グリオーマではグレード1のみを良性腫瘍と考えています。つまりグレード1は手術で全摘出できれば完治する可能性が高いのです。グレード2に関しては、手術で全摘出し得ても、半数が5年以内に再発すると報告されており、その5年生存率は乳癌のそれと大差がないのです。よってグレード2のグリオーマを良性腫瘍とする脳腫瘍の専門医はおりません。勿論グレード3、4は悪性グリオーマと呼ばれており、グレード3は退形成性星細胞腫、グレード4は膠芽腫(こうがしゅ)と呼ばれています。グリオーマの治療予後はこのグレードによって明確な差が示されています。5年生存率をみてもグレード2では66.7%、グレード3では23.4%、グレード4に至ってはわずか7%に過ぎません。このグレード4の5年生存率はすべてのがんの治療成績のなかでも1、2を争うほど悪いものなのです。("脳腫瘍とは"の図8を参照)
悪性脳腫瘍の代表がこのグリオーマであり、その他には悪性リンパ腫、胚細胞性腫瘍などがあります。勿論、続発性脳腫瘍である癌の転移は当然ながら悪性腫瘍となります。その他、極めて稀ながら髄膜腫や神経鞘腫、さらに骨・軟部腫瘍の悪性型が頭蓋内に発生することを経験します。
前述した様にWHOグレードで3あるいは4と診断されたグリオーマの予後は極めて不良です。正直に申し上げて、この様に診断された時点で治ることは無いと考えていただくべきです。我々は如何にして初回治療後に患者様の状態を改善させ、何としても自宅に帰れる状態にもってゆくことを目標としております。勿論、いずれ再発はやってくるので、それまでの期間を如何に延長させ、良い全身状態を維持できるかが重要になります。又、最近では如何に腫瘍と仲良く生きてゆくか(Tumor dormancy)という考え方が、難治性がんの治療目標として注目されております。再発時にどこまで治療を試みるか、無為な戦いは控え、緩和医療への橋渡しを考えるなど、脳腫瘍の治療において、極めて医師と患者およびその家族との間の信頼関係が求められる領域となります。この様な哲学にて、我々は悪性脳腫瘍の患者様に対峙することになります。以下に代表的な悪性グリオーマの一般的な診断・治療に関する情報を述べさせていただきます。
(1) 膠芽腫(グレード4):グリオブラストーマ
星細胞系腫瘍の最悪性の腫瘍が膠芽腫(こうがしゅ)です。近年の脳腫瘍の遺伝子解析の結果、星細胞腫が経時的に遺伝子の点突然変異を積み重ねて、徐々に悪性化して膠芽腫に至ったタイプ(Secondary glioblastoma)と、いくつかの遺伝子異常が急速に生じて発生したタイプ(Primary glioblastoma)の2つのタイプがあることが判明しました。当然ながら前者の方が、発病から診断までの期間が長く、後者では3か月前の頭部画像では全く異常が無いこともあるのです。
発病パターンとしては、腫瘍の発生部位によりそれぞれですが、基本的に膠芽腫は大脳半球に発生します。前頭葉35.4%、側頭葉24.8%、頭頂葉17.8%であり、小脳発生は2.2%、脳幹発生は1.4%に過ぎません。前頭葉に発生すれば、反対側の半身麻痺や失語症を、側頭葉では視野欠損や失語症、さらに認知症を思わせる症状で発病する場合が多い様です。痙攣発作はグレード2の症例で75%程度に認められるのに対し、膠芽腫では29-49%とされています。勿論、運動野や辺縁系などの痙攣を生じ易い部位の膠芽腫では痙攣発生に十分注意する必要があります。
診断には各種画像診断が有効であり、他臓器の癌の様な有効な血清腫瘍マーカーは存在しません。頭部CT scanやMRI、さらにSPECTやPETなどの最新機器を用いて、迅速かつ的確に診断することが、最善の治療につながる第一歩と考えます。膠芽腫のMRI所見において最も特徴的なのが、造影MRIによる環状増強効果(ring-like enhancement)です。一般に正常脳血管には血液脳関門(Blood Brain Barrier: BBB)があり、MRIの造影剤はBBBを超えて血管外に漏出することはありません。しかし膠芽腫は自らが増大するために多くの酸素や糖分を必要とするため、腫瘍の正常脳との境界側に、BBBを有さない未熟な血管を新生してゆきます。しかし、腫瘍の中心部は相対的に栄養不足となるため壊死を生ずるため、結果的に環状の増強効果が生ずることになります。
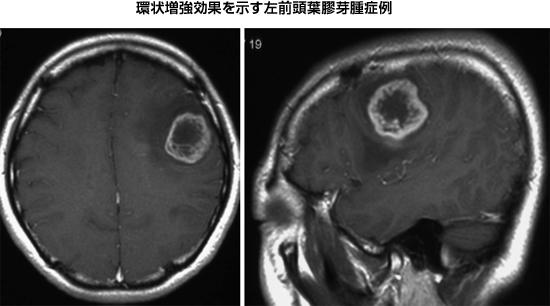 |
図4:造影MRIにて環状増強効果を呈する膠芽腫症例 |
近年のMRI撮像法の進歩は、膠芽腫の摘出において非常に大きな進歩をもたらしました。その中で我々は膠芽腫の浸潤範囲を評価する方法論としてのMR spectroscopy(スペクトロスコピー)に注目しています。膠芽腫においては、MRIで増強される腫瘍本体の周囲2-4cmの領域まで腫瘍細胞が浸潤しているとされており、治療においても同浸潤部への対応が重要となります。我々は3.0-Teslaの高磁場MRIを用いた、multi-voxel MR spectroscopyを用いて、膠芽腫の浸潤領域を評価してきました。まだまだ症例数も少なく、その評価法にも問題がありますが、膠芽腫では腫瘍本体から12.1mmの領域まで腫瘍細胞が浸潤している可能性を示しました。手術摘出範囲を設定する上で、極めて重要な情報と成り得るものとして、学会からも高い評価を受けております。
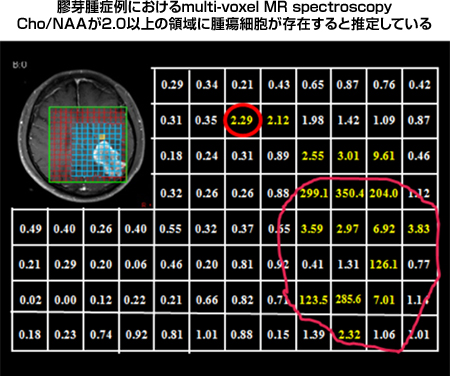 |
図5:MR spectroscopyによる膠芽腫の進展範囲の推定 |
さらにMRIは脳機能や脳神経の解剖において多彩な情報を提供してくれます。これらの情報は膠芽腫の摘出手術において、正常脳の機能温存という観点から極めて重要な摘出限界を示してくれるのです。代表的な撮像法として機能的MRIとDiffusion tensor image(DTI)があります。前者は言語や運動、視覚といった脳の重要な機能部位を示してくれ、後者は重要な神経線維の走行を示してくれます。これらの構造を如何に守りながら、浸潤部を含んだ最大限の摘出を行うことが、膠芽腫の治療予後の改善に繋がるのです。
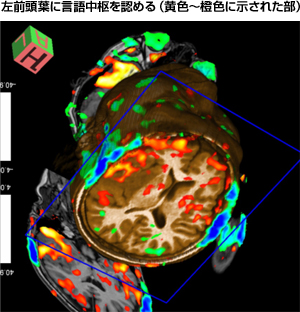 |
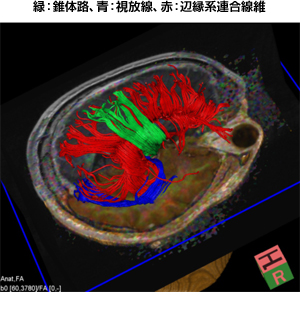 |
|
図6:機能的MRIで示した膠芽腫症例における |
図7:脳内の複雑な神経連絡路を示したDTI |
MRI以外の画像診断として最も注目されているのがMethionine-PET(メチオニンペット)です。最近の報告では、MRIの造影領域を超えた腫瘍の浸潤領域をMethionine-PETが示すとされ、的確な方法で評価することで、膠芽腫の摘出範囲の設定に極めて重要な情報となり得るものです。しかし、現時点ではMethionine-PETは保険診療の適応外となっており、検査を施行し得る施設も限られています。保険診療が可能であるFDG-PETに関しては、脳実質での糖代謝が盛んなために膠芽腫の診断には不向きとされています。
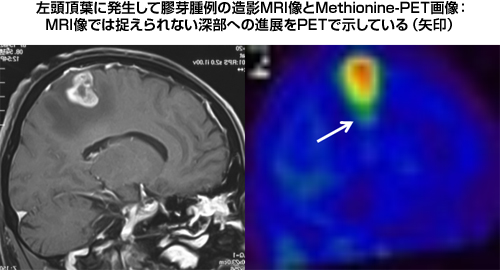 |
図8:Methionine-PETで高集積を示した膠芽腫症例 |
膠芽腫の治療は手術による摘出、放射線照射と化学療法の三本柱からなります。これらの治療を、膠芽腫症例ごとに如何に調整して行くかは、主治医の病態への理解力と経験値が大きな役割を占めますが、当然ながら患者様および御家族から十分なinformed consentを得た上で行われます。
手術摘出に関しては、可能な限り全摘出を目指すことが"是"と考えられておりますが、年齢、併発病態の存在、発生部位、大きさ、全身状態(Performance status:PS)などを踏まえて摘出度を決定することが通常です。30歳の右前頭葉の3cm径の腫瘍と、80歳の左言語野近傍の腫瘍を同じ土俵で手術摘出度を論ずる脳腫瘍専門医はおりません。我々は術前のPSを悪化させずに、可能な限りの摘出を行うことが"真の是"と考えております。この目的を達成するために、我々は多くの手術の補助的技術を用いております。代表的なものとしてニューロナビゲーションシステム、脳機能モニタリング、覚醒下手術があります。
ニューロナビゲーションとは、車のものと同様で、今、術者が膠芽腫症例の脳内のどこに触れているかをコンピューターが手術中に情報を提供してくれるシステムです。この情報があることにより、術者は自らの手術器具と腫瘍、および危険な正常脳構造との距離感を常に感じながら手術を進めることが可能となりました。何の目印もない脳実質の中で、運動・言語・視覚といった傷つけられない脳組織や正常脳血管との位置関係を、常に確認しながら腫瘍を摘出し得る安心感は、手術の摘出度の向上や術後の神経症状悪化の予防に確実に反映されております。
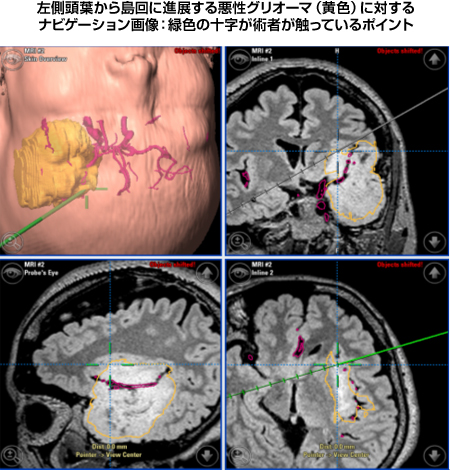 |
図9:術中ナビゲーション画像 |
脳機能モニタリングは、運動・感覚・視覚などの重要な脳機能の状態を、手術中に確認する方法論です。膠芽腫を摘出している最中にこれらの機能が温存されているかを、各機能の誘発電位の出現をもって確認しています。もし、これらの重要な機能に手術の侵襲が及べば、これらの誘発電位の振幅の低下や潜時の延長が認められます。皮質誘発運動誘発電位(Motor Evoked Potential:MEP)は錐体路の機能をリアルタイムに評価し得る方法ですが、我々は振幅が50%以下になった時点で、錐体路への侵襲が加わっているものを判断し、摘出を中断しています。
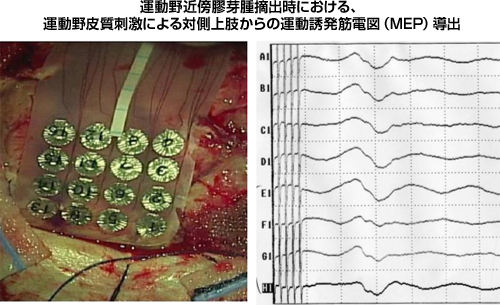 |
図10:運動野近傍のグリオーマ手術における術中MEPの推移 |
覚醒下手術とは、言語野近傍に発生した膠芽腫の摘出において、言語野の損傷を避ける目的に、手術中に必要な時点だけ麻酔を中断して覚醒状態とし、会話(物品呼称)を行いながら腫瘍を提出してゆく方法です。脳実質は痛みを感じ無いため、脳の電気刺激下に言語野を確認することが可能になります。直接の言語野(ブローカ野)刺激により、会話は完全に停止しますが、その周辺にも言語機能を補足する機能野があるため、詳細な言語機能評価を手術中に行う必要があります。我々の方法では、麻酔覚醒時間は1時間以内で済んでおりますが、あまり長時間となると不安感や嘔気、さらには頭部固定部の疼痛などが出現してしまい、覚醒を維持できなくなるので、なるべく短時間でスムースな言語野同定が求められます。安易な電気刺激は痙攣を誘発する危険性もあるため、麻酔科の十分な協力のもと、安全性を確保した覚醒状態維持が求められます。
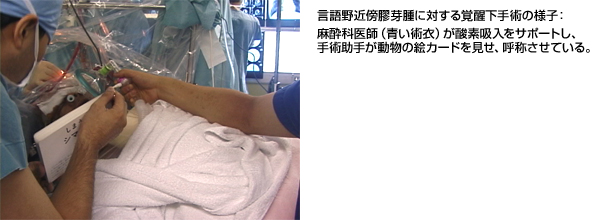 |
図11:左言語野近傍膠芽腫例に対する覚醒下手術 |
膠芽腫の放射線照射に関しては、拡大局所照射が一般的です。膠芽腫細胞は術前MRIで認められた造影本体の周囲に広く浸潤していることが知られており、仮に手術で本体を全摘出していても、術前画像を参考に、本体の周辺2cmの領域を十分含む様な照射野設定が求められます。照射線量は欧米の多くの多施設共同研究の結果から、55Gy(グレイ)以上の照射が求められています。しかし正常脳への侵襲への観点から80Gy以上の照射は適切とは言えないため、現在は60Gyの照射が世界標準と考えられています。通常は一回2Gyで30回の照射になりますので、月から金曜までの週5回、6週間の治療期間になります。照射早期の有害事象として脳浮腫の増強と放射線宿酔(食思の低下と意欲減退など)があり、照射後の遅発性合併症として認知機能の低下があります。認知機能低下の出現は年齢との関連性も高いと考えられており、高齢者への照射に関しては配慮が必要と思われます。放射線照射により脱毛が高率に生じますが、照射後3-6カ月で回復する場合が殆どと考えています。
膠芽腫の化学療法に関してはTemozolomide(TMZ:テモダール)の内服療法が一般的です。一種の抗癌剤であり、腫瘍細胞のDNAをアルキル化(傷をつける)することにより、その複製を不可能として腫瘍細胞死を惹起する薬剤です。日本では6年前に保険収載され、TMZが膠芽腫の第一選択抗癌剤として世界的に認知されています。スイスのRoger Stuppという脳腫瘍医が提案したTMZの服用法が最も有効とされており、具体的には放射線照射と同時期に朝空腹時に一回内服する方法です。即ち連日6週間(42日間)に亘り、体表面積
(身長と体重から算出)あたり75mgのTMZを42日間、空腹時に一日一回服用するものです。放射線照射が終了した後は、維持療法として月に5日間、150-200mgのTMZの内服を継続してゆきます。この方法論にて、従来の膠芽腫の平均生存期間である12.1カ月を14.6カ月と、2.5か月延長させることに成功したのです。わずか2.5カ月の延長にて、このStuppの方法が膠芽腫に対する最も有効な抗癌剤治療であるという評価を世界レベルで受けているのです。ただし、維持療法をいつまで継続するかは世界での標準的な考え方が確立されていませんん。欧米では6カ月から1年という場合が多い様ですが、我々は内服が可能であるうちは継続する方針としています。ただし、TMZの薬価は非常に高額であるため、継続のTMZの副作用としては嘔気があるため、内服前に制吐剤をまず服用します。さらに便秘の頻度が高い印象を抱きます。いつの間にかリンパ球数が低下していることが多く、注意をして対応しないとニューモシスチス肺炎という重篤な肺炎を合併する危険性も知られています。
以上、膠芽腫の診断と治療につき記載しました。如何にして術前画像で腫瘍の病態を十分評価し、患者様にとって最善と思われる手術、放射線治療、化学療法を組み合わせて、全身状態の良い状態を少しでも長く維持するかを、脳腫瘍医は毎日模索しているのです。
(2) 退形成性乏突起膠腫(グレード3)
本腫瘍は悪性グリオーマの一つの型なのですが、他の悪性グリオーマとは治療、およびその予後の観点から大きな差異があります。近年の分子生物学的研究の進歩により、脳腫瘍に関する遺伝子解析の知見が多く見出されました。その中で最も悪性グリオーマの診断・治療に大きな影響を与えたものが、染色体1番短腕(1p)と19番長腕(19q)の決失( Loss Of Heterozygosity:LOH)の発見です。この遺伝子異常の臨床的価値を示した論文が、全く同じ号の雑誌に欧州と米国から掲載されたのです。内容はほぼ同一であり、1p, 19qの両方に決失(1p19q co-deletion)がある悪性グリオーマは極めて治療効果が高いことが示されました。そして、両者の決失を有する腫瘍のほとんどが、乏突起膠腫の成分を有する腫瘍であることも既に報告されております。つまり、たとえ悪性グリオーマであっても、腫瘍内に乏突起膠腫の成分を有しており、1p19q co-deletionがあれば化学療法や放射線照射の効果が高まり、良好な経過を辿る場合が多いのです。退形成性乏突起膠腫はWHOの病理分類ではグレード3とされています。つまり乏突起膠腫の形態を有しながら、腫瘍細胞の異型性を有し、核分裂像が目立つのですが、壊死や血管増殖は認めない悪性脳腫瘍です。しかし、もしこの腫瘍が1p19q co-deletionを有していたならば、PCV (Procarbazine-CCNU-Vincristine併用)やTMZといった抗癌剤、拡大局所放射線照射の効果が期待できるのです。Cairncrossらの報告ではco-deletionがある本腫瘍の場合、PCV療法と放射線照射を組み合わせれば全例7年以上生存しているのに対し、無い症例では平均1.4年の生存期間しか得られなかったのです。如何に1p19q co-deletionが悪性グリオーマの予後因子として重要かを示していることになります。我々は術前診断でグリオーマが疑われる症例においては2007年から全例で1p19qLOHの有無をFISH法(Fluorescence In Situ Hybridization)にて検索しています。結果としてco-deletionを有する腫瘍のほとんどが乏突起膠腫系腫瘍であり、適切な補助療法を追加することにより良好な経過を示しています。
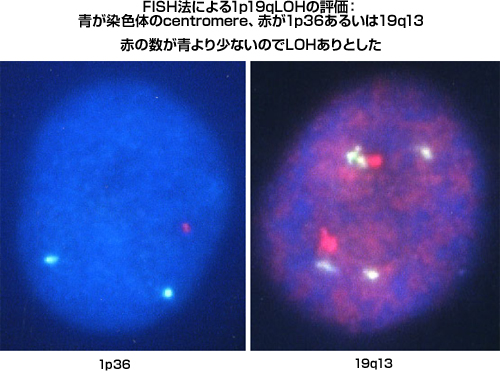 |
図12:FISH法による1p19LOHの検出 |
血液のがんとされる悪性リンパ腫は通常全身のリンパ節に発生することが多いのですが、脳に発生する場合があります。全身性のリンパ腫が脳に転移する場合と、脳にリンパ腫が発生する場合があり、後者を脳原発悪性リンパ腫(Primary Central Nervous System Lymphoma:PCNSL)と呼び、脳神経外科にて診断・治療する場合が多くなります。PCNSLは1980年代前半まではAIDSとの関連性で注目されていましたが稀な病態でした。しかし1990年代頃からAIDS等の免疫不全とは無関係に発生するPCNSLが世界的に急増しています。特に65歳以上の男性の症例が急増していますが、その原因は不明です。PCNSLは50歳台以降に発生することが殆どで、男性にやや多い傾向があります。PCNSLが発見する以前に、眼内のリンパ腫として治療を受けていたことがある症例が15-20%程度みられます。我々は当院眼科と連携し、眼内リンパ腫にて治療歴のある症例を、眼科煮ての診断の後に、定期的に脳MRIを行い、早期にPCNSLの発生を診断することを試みております。現在までに約40症例を経験しており、早期診断・治療を行うことによって、従来よりも良好な予後を示すことを報告しています。
悪性リンパ腫は大脳・小脳・脊髄などあらゆる脳内部位に発生しますが、大脳表面と比較的深部の傍脳室や辺縁系に発生することが多い印象をいだきます。必ずしも麻痺や失語といった脳局所症状ではなく、認知症を思わせる様な高次脳機能障害で発症することも稀ではありません。一度発症すると、病状の進行は急速であり、迅速な診断ができないとあっという間に重症化し、頭痛や嘔吐などの頭蓋内圧亢進症状どころか、意識障害を来たしてくることもあります。とにかく迅速に診断することが、治療効果や後遺症の観点から重要な疾病なのです。画像診断ではMRIの拡散強調画像所見(diffusion weighted image:DWI)と造影効果にて凡そ可能です。特徴的な発生部位、DWIでの輝く信号、均一で強い増強効果、多発性などを確認すればPCNSLの可能性は高いものと判断します。又、核医学検査のSPECTも有用な場合があります。Gallium-SPECTでの陽性像が特徴的ですが、IMP-SPECTでの陽性像がPCNSLの診断感度が高い様です。腫瘍マーカーとしてのβ2-マイクログロブリンに関しては、血清では軽度上昇に留まりますが、髄液にて3.0mg/dl以上を示すことが一つの診断指標になる印象を抱いています。全身性リンパ腫の診断に有用とされる可溶性IL-2受容体に関しては、PCNSLでは血清、髄液とも上昇することは殆どありません。本物質はTリンパ球がBリンパ球性リンパ腫に対する反応として産生するものであり、リンパ組織が存在しない脳内ではこの様な反応が起こりずらいことが一因と考えています。
これらの画像や腫瘍マーカーにてPCNSLを十分推定可能なのですが、確定診断のためにはどうしても組織診断が必要です。高齢者や深部発生例も多く、多くの検討が全摘出を行うことの意義を否定していることからも、腫瘍の生検に留める場合が殆どです。病理像としては95%が非ホジキン型びまん性大細胞型B細胞リンパ腫(Diffuse large B-cell lymphoma:DLBCL)であり、表面マーカー検索にてCD20陽性であるか否かが重要となります。
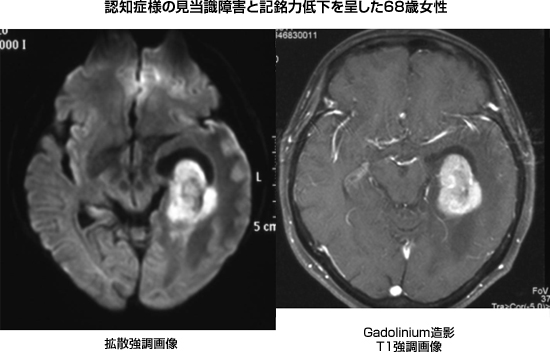 |
図13:悪性リンパ腫の典型的な画像所見 |
PCNSLの治療は大量メソトレキセート療法(以下HD-MTX)を中心とした化学療法です。1990年頃まではPCNSLに対しては放射線照射を中心に治療しておりましたが、再発率が高く、再発時には治療法が無いため、生存期間が1年程度と極めて不良でした。しかしHD-MTXの有効性を示した報告が相次ぎ、現在ではHD-MTXを2週間間隔で3回行い、その後に放射線照射を行う治療法が一般的となりました。脳には血液脳関門という血管壁のバリアがあるため、全身性リンパ腫に用いるメソトレキセートの量では腫瘍の薬剤が到達しないため、大量(全身性リンパ腫の5~10倍)の薬剤を静脈投与します。我々は大量の薬剤が皮下に漏れることを予防するために末梢挿入型中心静脈カテーテルを早期から導入し、安全な薬剤投与を行っています。当然抗癌剤の副作用としての腎毒性があるため、細かな尿量、尿のpHのチェックなどを行い、厳重な全身管理のもとに施行しています。HD-MTXを3回施行した後に、腫瘍の完全消失が得られない場合は、全脳放射線照射30Gyを行いますが、高齢者の場合は将来、高次脳機能障害の原因となる白質脳症が発生することを危惧し、施行しない場合が多くなっています。この方法で現在の平均生存期間は3~5年と報告されており、当院でも同等の結果が得られております。最近では腫瘍組織にCD20が発現している場合は、Rituximab(リツキサン)をHD-MTXに併用する方法で行い、腫瘍縮小率の上昇が得られ、放射線照射を回避できる症例が増えてきています。ただ、この方法でも悪性腫瘍であるPCNSLを完治し得るものではありません。かならず再発は訪れるのですが、現在PCNSLの再発時にどの様な治療方針で望むべきか、世界レベルで確立された意見が無いのが実情です。我々は大量Ara-C療法という新しい方法(ESHAP療法)を試みておりますが、再発時にはこの厳しい抗癌剤治療に耐えられる状況でないことが多く、施行しきれていない現状があります。
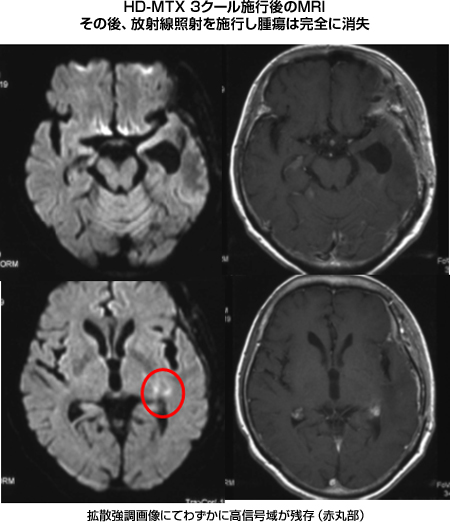 |
図14:悪性リンパ腫の典型的な画像所見 |
原子胚細胞が精巣あるいは卵巣に分化してゆく過程での何らかの細胞移動傷害により、中枢神経系に迷入したことで、本来生殖器に発生する腫瘍が脳内に発生した腫瘍です。発生頻度としては全脳腫瘍の2-3%、小児脳腫瘍の8-15%ですが、興味深いことにアジア圏、特に日本と韓国からの報告が極端に多いのです。欧米の4-8倍の頻度で発生すると言われていますが、その原因は不明です。それ故、本腫瘍の病態、診断や治療に関する情報は、この2国からのものが殆どで、世界的な治療方針確立に寄与してきました。
胚細胞性腫瘍は、胚細胞腫(germinoma)と非胚細胞腫(non germinoma)に分類されます。これは脳発生例の8割近くが前者であり、胚細胞腫か否かで治療予後が大きく異なることに起因しています。胚細胞腫の80-90%が25歳以下の小児に発生し、殆どが10歳台なのです。そして75-80%が男性であることも特徴的と思われます。発生部位は男性例では60-70%が松果体ですが、女性例では15-20%が松果体発生で、神経下垂体部に発生することの方が多いという特徴があります。その他、脳幹、大脳基底核部などの報告も見られますが、腫瘍の発生概念からも、殆どが脳の正中線上に発生するということも特徴的といえるでしょう。
脳腫瘍には基本的に腫瘍マーカーは無いと前述しましたが、胚細胞性腫瘍ではAFP(αfeto-protein)とhCG-β(Human chorionic gonadotropin)の血清あるいは脳脊髄液中の測定によって診断される場合があります。最も頻度の高い胚細胞腫ではいずれのマーカーも正常域であるのですが、卵黄嚢腫や胎児性癌などの非胚細胞腫ではこれらのマーカーが高値を示し、診断価値を有する場合があります。画像診断が特徴的であり、腫瘍の発生部位が松果体と神経下垂体部で9割近いことが最も重要で、されに境界明療か否か、円形か否か、石灰化の有無、造影効果の状況、腫瘍周囲浮腫の程度などから胚細胞腫瘍の画像診断を行ってゆくことが殆どです。しかし、確定診断を得るためにはやはり組織診断が重要であると考えますが、腫瘍の発生部位が松果体という、非常に脳の深部であるため、組織診断は必ずしも安全に施行し得るものではありませんでした。しかし、近年では神経内視鏡手術の技術向上が得られたため、同方法論にて脳室内から比較的安全に腫瘍組織を得ることが可能となっています。多くの場合は松果体部腫瘍による中脳水道狭窄症からの閉塞性水頭症を伴っていることが多いため、神経内視鏡手術により第三脳室開窓術を同時に行えば、腫瘍生検と水頭症の改善という2つの手術効果が得られるのです。
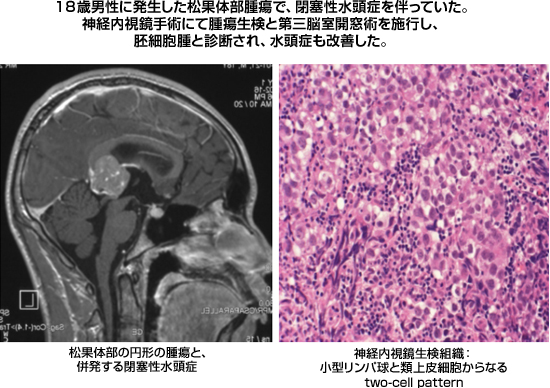 |
図15:松果体胚細胞腫の水頭症合併例に対する神経内視鏡手術 |
治療法としては前述した通り、本邦で開発され広く普及している化学療法と放射線照射の組み合せが世界的な評価を受けています。胚細胞腫であればまず2種類(カルボプラチンとエトポシド)の抗癌剤治療を3回施行し、腫瘍の完全消失が得られなかった場合には、全脳室系を含む24Gyの放射線照射を行います。本治療により殆どの胚細胞腫は消失し、維持療法を行わなくても再発することは稀で、10年生存率は92.7%に達するのです。本治療法では悪性脳腫瘍である胚細胞腫の予後をここまで良好なものとしたのです。しかし非胚細胞性腫瘍ではこの様にはいきません。化学療法も強い3種類の薬剤(イホマイド、シスプラチン、エトポシド)を用いたものを3回行い、放射線照射も50Gyを行い、かつ髄液播種の予防のため全脊髄にも30Gyの照射を要するとされます。これほど強い治療を行っても、再発率は90%を超え、胎児性癌の3年生存率は30%、卵黄嚢腫瘍の1年生存率は33%、絨毛癌では1年生存0%と悲惨なものなのです。如何に胚細胞腫なのか否かで治療予後が異なる腫瘍であるかが御理解いただけたと思います。
当院では最新の画像診断機器と豊富な神経内視鏡手術の経験をもとに、迅速な診断を心がけています。化学療法の経験も豊富であり、放射線治療部との連携のもと、本腫瘍に対する的確な治療を施行し得ていると自負しております。
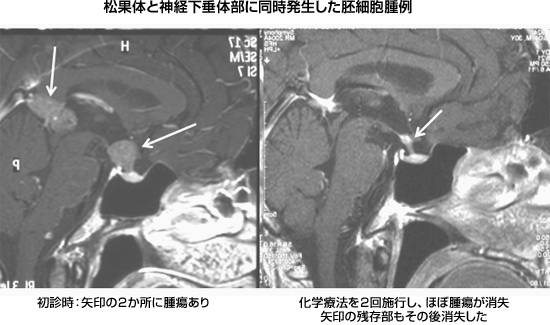 |
図16:松果体と神経下垂体部に同時発生した胚細胞腫例。化学療法のみで消失 |



