診療案内はこちら ⇒ 東京医科大学病院 脳神経外科 ホームページ
局所再発を如何に予防するかが悪性グリオーマ制御の最大の課題であり、この観点から現在では多彩なmodalityを用いて最大限の摘出を図る手術が行われている。しかし、手術摘出度の向上は、PFS(progression free survival)の延長に繋がったが、決してOS(overall survival)の延長を得るまでには至らなかった。1) 術前MRIでの造影領域(tumor bulk)をターゲットとした手術の限界を示していると同時に、bulk周囲2-4cmの腫瘍細胞浸潤域の制御の必要性を示唆している。近年ではMethionine PETやMR spectroscopyで評価した腫瘍の浸潤先端(invading front)をターゲットとした拡大摘出も試みられるが、言語・運動・視覚などの機能野への浸潤を認めた場合は、摘出の限界と言わざるを得ない。そして必ず腫瘍はそこから再発する。
PDTは、腫瘍組織や新生血管への集積性がある光感受性物質を患者に投与した後、組織にレーザ光を照射することにより光感受性物質に光化学反応を引き起こし、細胞を変性・壊死させる治療法である。この細胞の変性・壊死は、特定の波長のレーザ光と光感受性物質との光化学反応によって産生される一重項酸素(ROS:reactive oxygen species)の強い酸化作用によるものである。2)
PDTは、光感受性物質が存在し、レーザ光が照射された部位のみに光化学反応を起こさせ、細胞を変性・壊死させる局所的療法である。この作用の主役であるROSの寿命は0.04~4μ秒と短く、更にPDTで使用するレーザは一般的なレーザ治療に用いられる高出力のものとは全く異なり、出力が弱く、手をかざしてもほとんど熱さを感じない程度であり、反応が起こる範囲を光感受性物質が集積した病変部位へとだけにコントロールできることが特徴である。これらのことから、PDTは正常組織への侵襲性が少ない病変部位選択的な治療法として、様々な疾患領域において発展していくことが予想される。2)
前述した様に、悪性脳腫瘍の治療では、浸潤腫瘍細胞と正常脳組織の混在部位において、腫瘍細胞だけを選択的に傷害し得るかが最大の鍵となる。この腫瘍選択的な治療法が確立できれば、腫瘍細胞の根絶と神経機能の維持という相反する課題の克服に近づくことが理論上可能である。
悪性脳腫瘍に対する我々の狙いは、手術により最大限に腫瘍組織を摘出した後の残存浸潤腫瘍細胞をPDTによって選択的に傷害し、神経機能を温存しつつ腫瘍再発までの期間を延長させることにある。現在施行し得る最善の技術を用いた外科的手技に、PDTという光化学反応に基づいた術中追加治療を加えることにより、従来の集学的治療への上乗せ効果が期待でき、生存率の更なる向上に繋がるものと考えている。2)
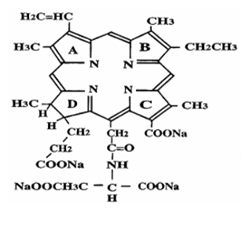
Talaporfin sodium(商品名レザフィリン®)(Fig.1 A, B)は第二世代の光感受性物質であり、半導体レーザ(商品名:PDレーザ)との組み合わせによるPDTは、早期肺癌に対する治療として2003年に保険承認されている。3) レザフィリン®は第一世代の光感受性物質であるフォトフリン®と比較して体内からの排泄速度が速いため、光感受性物質の投与で問題となる光線過敏反応の消失が早いという特長がある。これにより、フォトフリンでは投与後少なくとも1ヵ月間は300ルクス以下の薄暗い室内で過ごす必要があったが、レザフィリン®では500ルクス以下の室内で2週間以内と、遮光度の軽減およびその期間が短縮された。レーザ装置に関しては、フォトフリン®と組み合わせて用いられるエキシマダイレーザあるいはYAG-OPOレーザは、装置の大きさが飲料自動販売機程度あり、本体質量は250 kg以上と人力では持ち上げられないものであった。しかし、レザフィリン®と組み合わせて用いられる半導体レーザ装置は、質量14 kg、ビデオデッキ程度の大きさであり、一人でも持ち運べるサイズまで小型・軽量化された。(Fig.2 A)また、消費電力も少なく、色素交換が不要でメンテナンスが容易といった特長もある。さらに、早期肺癌に対する有効性はフォトフリンと同程度以上の成績が得られたのである。3)
これらの特長は臨床現場では非常に大きなベネフィットとなり得ると考え、レザフィリン®と半導体レーザを用いたPDTを悪性脳腫瘍の治療に適用することを目的に、我々は2001年から非臨床研究を開始、学内倫理委員会承認の後、2004年から臨床研究を開始した。
ラット脳腫瘍移植モデルにおいて、レザフィリン®を用いた蛍光診断(Photodynamic diagnosis;PDD)及びPDTの抗腫瘍効果を検討した。その結果、PDDではレザフィリン®の分布を示す蛍光強度と腫瘍細胞の密度に関連性がみられた。4) 更にPDTでは腫瘍細胞の凝固壊死及びアポトーシスが誘発され、抗腫瘍効果も確認されたのである5)。更にヒトグリオーマ細胞(T98G, A172, U251)を用いたPDT効果の検証にて、レザフィリン®の的確なdose(25-30㎍/ml)下にPDTを行えば、経時的な細胞死が確認され、その細胞死はcaspase-3の活性上昇を伴うapoptosisが主体であることも立証している。
悪性脳腫瘍患者を対象とした臨床研究を実施した。レザフィリン®は早期肺癌の適応量と同じ40 mg/m2単回静脈内投与とした。手術にて開頭後、露出された脳に半導体レーザ装置を用いて664 nmのレーザ光を照射(10mw/cm2)することによりPDDを実施し、腫瘍本体、正常脳への浸潤部、正常脳を同定した。また、腫瘍摘出を行った上で、機能野などに浸潤腫瘍が残存した場合あるいは残存が疑われた場合は、残存腫瘍組織に対してPDTを施行した。薬剤投与からレーザ照射までのインターバル時間は24時間を基本とした。PDT照射パワーについては早期肺癌適応と同一の150mW/cm2としたが、PDT照射エネルギー密度については27 J/cm2を基本とした。(Fig.2 B) 有効性の評価項目はレーザ照射部位における増悪抑制、全生存(OS)とした。また、有害事象及び副作用の検討を行い、安全性を評価した。
膠芽腫を対象にPDTが施行された12例(初発4例、再発8例)の腫瘍縮小効果は、CR 2例、NC 2例、PD 4例、NE 4例であった。12例の6ヵ月PFS率は28.0%(95%信頼区間:0.0%-70.3%)であったが、レーザ照射部位における6ヵ月増悪抑制率は77.8%(95%信頼区間:50.6%-100.0%)であり、12例中10例でレーザ照射部位には増悪を認めていない。また、OS期間中央値は9.0ヵ月であり、12ヵ月OS率は45.7%(95%信頼区間:1.8%-89.7%)であった。対象症例の多くが再発例であり、腫瘍が機能野またはその周辺部位に位置している治療困難な症例であったことを考慮すると良好な成績と考えられた。
58例の脳腫瘍にレザフィリン®を投与したが、有害事象によって死亡した症例はなかった。臨床検査値に関する重篤な副作用はALT/AST増加、LDH増加が1例に認められた。この1例は、レザフィリン®投与後に急性肝障害を発現し、PDDおよびPDTの実施を中止した。その他の重篤ではない副作用としては、嘔吐、発熱、肝障害、四肢痛、譫妄、ALT/AST増加、LDH増加、γ-GTP増加、ALP増加が数例で認められた。以上の結果より、レザフィリン®と半導体レーザ装置を用いたPDTは、悪性脳腫瘍の術中追加療法となり得ると思われた。
ドイツで施行された悪性脳腫瘍手術に対する、光感受性物質5-aminolevulinic acid (5-ALA)を用いた術中蛍光診断(PDD)による腫瘍摘出度向上と予後に関する第III相試験の結果1) によると、6ヵ月無増悪生存率が改善された(5-ALA: 41.0% vs White light: 21.1%, p=0.0003)ものの、生存期間の延長には至らなかった(5-ALA: 13.5 months vs White light: 15.2 months, p=0.1)。このことは、術中蛍光診断に基づく手術摘出の限界を示しており、局所浸潤腫瘍細胞の制御無くしては、悪性脳腫瘍の生命予後の改善は得られないことを改めて示す結果となった。
PDTの目的は、この浸潤腫瘍細胞を光化学反応にて選択的に傷害することである。具体的には、術前画像診断で確認し得る腫瘍本体を術中蛍光診断を用いて可及的に全摘出した後、摘出が困難な機能野へ浸潤した腫瘍細胞を、正常神経組織の損傷無く傷害する。PDTによる術中追加治療の有用性を評価するためには、腫瘍再発の制御とともに、神経機能の維持が、安全性という観点から求められるわけである。2)
狭義のPDT概念では細胞レベルでの障害、すなわちapoptosisをその機序としたdirect damageをtargetとしたものであるが、多くの報告は腫瘍血管内皮の障害によるfibrin血栓形成に起因する血管閉塞がPDT障害の主機序であるとしている。特にレザフィリン®と半導体レーザを用いたPDTによって惹起される細胞障害はこのindirect damage、すなわち腫瘍血管閉塞による凝固壊死が主機序と考えられている。2,3)5)我々の基礎実験系においても、C6 glioma組織はレーザ照射した腫瘍表面に近い部分では凝固壊死組織が、遠い部分では細胞死が生じていた。5) しかし実際の組織障害の面積比を考えれば、その80%に及ぶ部分が前者による組織障害であったのである。Yamamotoら6) は癌組織に対するPDT施行後、20秒以内に血管内皮細胞障害に起因する13因子の活性化が生じ、フィブリン血栓が形成されるとされ、本機序がPDTの主機序であると述べた。
前述した様に、我々の戦略は、PDDで認識される所謂tumor bulkを手術にて可及的に摘出し、重要な機能を有する部に進展する蛍光陽性組織に対してPDTを行うものである。PDTの血管障害性のみが前面に出てしまうと、正常脳組織へのdamageが生ずる可能性が高いものと思われる。Madsenら7) はPDT効果を左右する因子として、組織側の因子としての光感受性物質の組織内濃度、組織の酸素化の程度、レーザ照射部からの深度を、照射レーザ側の条件としての照射エネルギー、照射時間の設定をあげている。如何にしてvascular effectよりもcytotoxic effectを高められ、正常脳組織の障害を最小限に抑えられるかが、悪性グリオーマの治療にPDTが参入し得る否かの鍵となるであろう。2)
今回の我々の方法論では、早期肺癌に対するPDTにおいて承認された照射パワーである150mW/cm2を用いたが、薬剤の投与から24時間後という、血液中からのある程度のwash outが得られた時期を選択、さらに照射時間を抑えることにより、照射エネルギー27J/cm2をPDT条件と設定した。2) 12例という少ない経験であるが、この条件により術後の画像診断、神経症状の観察からもPDTによる直接的な有害事象を経験していない。CR2例においては術前の神経症状の改善すら得られており、本PDT条件においては正常脳機能を損傷するリスクは少ないと思われた。しかしPDT施行条件に関しては十分検討を加えるべきと考えている。最近Bislandら8)が低doseの5-ALAを数時間に分けて投与したラット脳腫瘍モデルに対し、低doseの光照射を長時間かけて行ったところ、血管障害性壊死は全く生じず、浸潤部の腫瘍colonyにのみapoptosisを惹起できたと報告した。彼らの提唱するmetronomic PDTを臨床に応用する為には、植込み型のレーザプローブなどのdeviceの開発が必要と思われ、理想的なPDTを施行するために今後も検討を重ねてゆきたい。
PDTが物理化学的論理に基づいた治療戦略であることを理解していただけたものと思う。Stummerらも5-ALAを何とかPDTへ応用すべく非臨床研究を重ね、組織内レーザー照射による臨床治験を始めている。9) 比較的小型の再発glioblastoma10例を対象とした、組織内PDT(633nm, 100J/cm2)の結果9)では、平均15ヶ月の生存期間が得られ、有害事象も経験しなかったという。この方法で56ヶ月のprogression free survivalが得られた再発glioblastoma症例を最近報告しており10)、悪性グリオーマに対するPDTの効果が現実味を帯びてきた。
我々もレザフィリン®と半導体レーザを用いた、悪性グリオーマに対するPDTの医師主導治験を東京女子医科大学脳神経外科とともに施行した。2年間の症例登録(平成23年3月31日まで)を終え、現在症例解析中であるが、"日本発"の悪性グリオーマに対するPDTのevidenceを構築できる日も近い。レザフィリン®を励起するレーザ光は5-ALAの励起光よりも長波長 (664nm)であり、脳組織への進達度も理論的に高い。悪性グリオーマの浸潤先端をより深く傷害し得るという観点からも、我々のprotocolはStummerらの成果以上の治療効果を示すものと信じており、本治験の成果が厚生労働省に承認されれば、悪性グリオーマの治療に苦しむ多くの日本国民の光明となるものと思われる。
| 1) | Stummer W, Pichlmeier U, Meinel T, et al: Fluorescence-guided surgery with 5-aminolevulinic acid for resection of malignant glioma: a randomized controlled multicentre phase III trial. Lancet Oncol 7:392-401.(2006) |
| 2) | 秋元治朗、冨田丈博、橋本孝朗 他:浸潤先端をターゲットとしたグリオーマの手術。 脳腫瘍の外科、甲村英二(編)、メデイカ出版、pp8-14(2008) |
| 3) | Usuda J, Ichinose S, Ishizumi T, et al: Outcome of photodynamic therapy using NPe6 for bronchogenic carcinomas in central airways >1.0cm in diameter. Clin Cancer Res 16(7), 2198-2204, 2010 |
| 4) | Matsumura H, Akimoto J, Haraoka J et al: Uptake and retention of the photosensitizer mono-L-asparthyl chlorine e6 in experimental malignant glioma. Lasers Med Sci 23, 237-245, 2008 |
| 5) | Namatame H, Akimoto J, Matsumura H et al: Photodynamic therapy of C6-implanted glioma cells in the rat brain employing second-generation photosensitizer Talaporfin sodium. PDPDT 5, 198-209 、2008 |
| 6) | Yamamoto Y, Shibuya H, Okunaka T et al: Fibrin plugging as a cause of microcirculatory occlusion during photodynamic therapy. Lasers Med Sci 14, 129-135, 1999 |
| 7) | Madsen SJ, Angell-Petersen E, Spetalen S et al: Photodynamic therapy of newly implanted glioma cells in the rat brain. Lasers Surg Med 38, 540-548, 2006 |
| 8) | Bisland SK, Ligle A, Lin A, et al: Metronomic photodynamic therapy as a new paradigm for photodynamic therapy: rationale and preclinical evaluation of technicalfeasibility for treating malignant brain tumors. Photochem Photobiol 80, 22-30, 2004 |
| 9) | Beck TJ, Kreth FW, Beyer W, et al: Interstitial photodynamic therapy of nonresectable malignant glioma recurrences using 5-aminolevulinic acid induced protoporphyrin Ⅸ. Lasers Surg Med 39(5), 386-393, 2007 |
| 10) | Stummer W, Beck T, Beyer W, et al: Long-sustaining response in a patient with non-resectable, distant recurrence of glioblastoma multiforme treated by interstitial photodynamic therapy using 5-ALA: case report. J Neurooncol 87(1), 103-109, 2007 |
 |
 |
|
A:Talaporfin sodiumの構造式:植物クロロフィル由来の |
B:光線力学的治療薬剤:レザフィリン® |
 |
 |
|
A:半導体レーザ装置:PDレーザ® |
B:レーザ光を手術顕微鏡の鏡筒に誘導し、 |
 |
 |
|
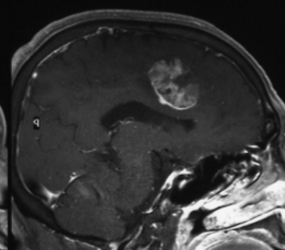
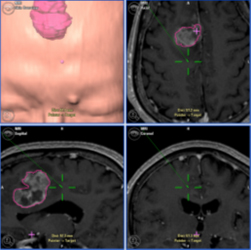
A:65歳男性。右前頭葉の内側面に発生した膠芽腫だが、 |
B:下肢運動モニタリングにて腫瘍を摘出したが、 |
|
 |
 |
|
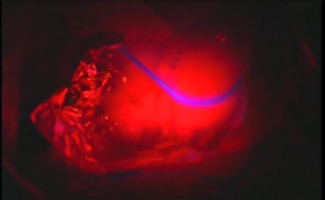
C:同部を切除すると左下肢麻痺を後遺するため、 |
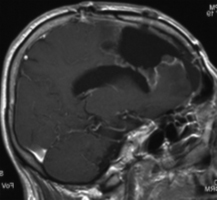
D:術後MRIにてPDT施行部は組織の欠損の様に |
|