エクソソームとmiRNA
【エクソソーム(exosome)とは?】
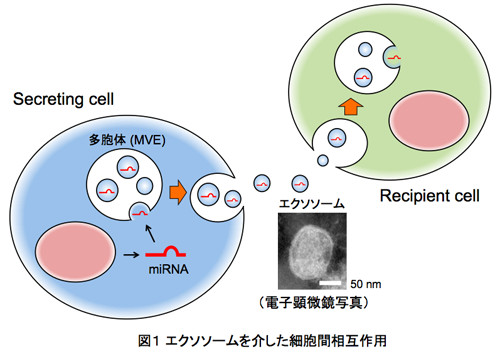
近年、「エクソソーム」と呼ばれる細胞外小胞(図1)に注目が集まっています。「エクソソーム」自体の発見は今から30年ほど前にさかのぼりますが、発見当初は細胞の不要物的な存在としか認知されず、その機能や存在意義などは長い間、不明でした。ところが、2008年にエクソソーム内にmRNAやmiRNAを含む核酸物質が内包されて他の細胞へと受け渡されている可能性が示されるや否や、ここ数年の間に関連研究が一気に加速し、今日に至っています。
【バイオマーカーとしてのエクソソーム・miRNA】
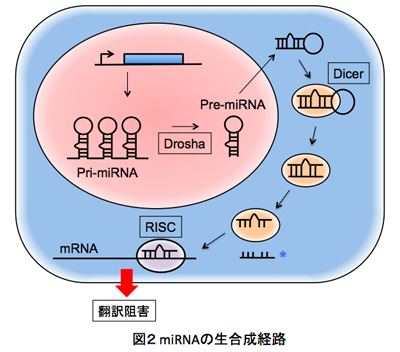
わたしたちの研究室では、エクソソームを介して細胞外へ放出されているmiRNAの存在に着目し、非侵襲性で感度の高いバイオマーカーの確立を目指して、白血病や悪性リンパ腫など造血器腫瘍患者の血清中miRNAを用いた診断・予後マーカーの探索を行なってきました。 miRNAは18-22塩基の小分子RNAの一種で、細胞内でmRNAと結合してその転写を制御することが知られています(図2)。わたしたちがこの研究を始めた2008年頃は、血清を含む体液中(細胞外)にmiRNAが存在するメカニズムや意義についてはよくわかっていませんでしたが、東京医科大学血液内科学分野および分子病理学分野と共同研究を展開し、急性白血病、悪性リンパ腫、骨髄腫患者由来の血清中においてmiR-92aが著減することを見いだし、次々と報告してきました(1, 2, 3, 4)。そして、この血清中miR-92aを革新的バイオマーカーとしてプレスリリースを行ない大きな反響を呼びました。また、2013年には呼吸器内科学分野との共同研究により慢性閉塞性肺疾患における血清中miR-106bの診断的意義についても報告しました(5)。このように血清中miRNA診断の個別化医療への実現をめざして、血清中miRNAを包括するエクソソーム分画回収の方法論的問題点を改善し、慢性骨髄性白血病におけるmiRNAによる治療適正化診断に関する研究(6)など、より臨床に直結したアプローチを試みています。
【エクソソーム・miRNAのバイオロジーから治療へ】
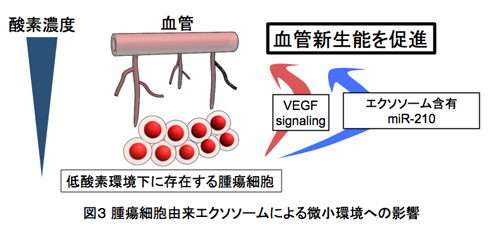
わたしたちはこれらの血清中miRNAを用いたバイオマーカーの開発のみならず、細胞外へ放出されるエクソソーム含有miRNAの存在意義、特に「がん微小環境」でのエクソソームの役割を明らかにし、最終的にはこのエクソソーム含有miRNAをターゲットとした新たな治療戦略の開発を目指して研究を展開しています。がん細胞はその周辺の正常細胞(間質細胞、血管内皮細胞)と相互作用して「がん微小環境」を構築することにより維持されています。すなわち、これまでのがん細胞を標的とした治療法ではなく、「がん環境」を標的とした治療法を開発するには、まずがん微小環境のメカニズムを解明することが必要です。わたしたちの研究室では、がん微小環境での新たな細胞間シグナル伝達メカニズムとして、がん細胞が放出するエクソソームが関与していることを世界に先駆けて証明しました(7)。そして、がん微小環境の中でも重要な環境要因の一つである「低酸素環境」に注目し、低酸素環境に曝されたがん細胞が放出するエクソソームが、周辺の血管内皮細胞に及ぼす影響について詳細な検討を行いました。その結果、低酸素環境下に曝されたがん細胞内で顕著に発現上昇するmiR-210が、エクソソームを介して血管内皮細胞に取り込まれていることを独自開発したin vitroモデル系で証明し、さらに低酸素曝露したがん細胞由来エクソソーム(miR-210を多く含有する)は、血管内皮細胞内のEphrinA3を抑制することにより血管新生能を促進することを見出しました(8、図3)。これらの仕事をさらに発展させ、2013年以後は低酸素環境に長期間曝露した生体内環境に近い骨髄腫細胞が放出するエクソソーム含有miRNAを新たな標的とし、in vivoモデル系を用いて、新たな治療戦略の開発を目指しています。
【エクソソーム研究のこれから】
今では、「エクソソーム」が細胞の分化・老化や免疫系の制御などさまざまな生命現象に関与していることが明らかになり、今後も一つの研究分野として発展して行くことは間違いありません。国際細胞外小胞学会(ISEV)も2014年で第4回目を迎え、細胞外小胞(extracellular vesicles: exosomeおよびmicrovesicle (MV)を含む総称)の機能や分泌メカニズムなどの生物学的知見に加え、それらに内包されるmiRNAや機能性タンパクをターゲットとした疾患マーカーや治療法の開発など臨床応用を目指した研究が多数報告されました。その一方で、「エクソソーム」というキーワードだけが先行している印象がありますが、エクソソーム(30-100nm)は「細胞外小胞」の中の氷山の一角であり、まだ未解明の部分が多く残されているのが現状です。このサイトでは今までのわたしたちの研究成果の概要をご紹介いたしましたが、今後もバイオロジーから臨床研究まで、様々なアプローチで研究を展開して行きたいと考えています。
| 参考文献 | |
| 1. | Tanaka M, Oikawa K, Takanashi M, Kubo M, Ohyashiki JH, Ohyashiki K, Kuroda M. Down-regulation of miR-92a in human plasma is a novel marker for acute leukemia patinets. PLoS One. 2009; 4(5): e5532. [pubmed] |
| 2. | Ohyashiki JH, Umezu T, Kobayashi C, Hamamura RS, Tanaka M, Kuroda M, Ohyashiki K. Impact on cell to plasma retio of miR-92a in patients with acute leukemia: in vivo assessment of ell to plasma ratio of miR-92a. BMC Res Notes. 2010; 3: 347. [pubmed] [PDF] |
| 3. | Ohyashiki K, Umezu T, Yoshizawa S, Ito Y, Ohyashiki M, Kawashima H, Tanaka M, Kuroda M, Ohyahsiki JH. Clinical impact of down-regulated plasma miR-92a levels in non-Hodgkin's lymphoma. PLoS One. 2011; 6(2): e16408. [pubmed] |
| 4. | Yoshizawa S, Ohyashiki JH, Ohyashiki M, Umezu T, Suzuki K, Inagaki A, Iida S, Ohyashiki K. Downregulated plasma miR-92a levels have clinical impact on multiple myeloma and related disorders. Blood Cancer J. 2012; 2(1): e53. [pubmed] |
| 5. | Soeda S, Ohyashiki JH, Ohtsuki K, Umezu T, Setoguchi Y, Ohyashiki K. Clinical relevance of plasma miR-106b levels in patients with chronic obstructive pulmonary disease. Int J Mol Med. 2013; 31:533-539. [pubmed] |
| 6. | Ohyashiki JH, Ohtsuki K, Mizoguchi I, Yoshimoto T, Katagiri S, Umezu T, Ohyashiki K. Downregulated microRNA-148b in circulating PBMCs in chronic myeloid leukemia patients with undetectable minimal residual disease: a possible bio,arker to discontinue imatinib safely. Drug Des Devel Ther. 2014; 8: 1151-1159. [pubmed] |
| 7. | Umezu T, Ohyashiki K, Kuroda M, Ohyashiki JH. Leukemia cell to endothelial cell communication via exosomal miRNAs. Oncogene. 2013; 32(22): 2747-2755. [pubmed] [PDF] |
| 8. | Tadokoro H, Umezu T, Ohyashiki K, Hirano T, Ohyashiki JH. Exosomes derived from hypoxic leukemia cells enhance tube formation in endothelial cells. J Biol Chem. 2013; 288(48): 34343-34351. [pubmed] [PDF] |
| *本研究は、文部科学省・私立大学戦略的研究基盤形成支援事業「ナノ医工学を応用した再生医学研究拠点形成:事業番号S1001015」と「生体分子情報による次世代型がん個別最適化治療法の開発:事業番号S1311016」の助成を受けたものです。 |